摘要
子宫内膜异位症为育龄期妇女的多发病和常见疾病,严重影响着患者的生育能力和生活质量。泛素蛋白可广泛地分布于各种细胞中,参与调控细胞周期、信号转导、细胞凋亡、转录调节、炎症反应等许多生理或病理过程。近年研究显示,泛素蛋白参与了子宫内膜异位症的发生与发展,因此本文就不同泛素蛋白在子宫内膜异位症中的作用作一综述。
【关键词】子宫内膜异位症;E3泛素连接酶;去泛素化酶
基金项目:上海市卫生健康委员会卫生行业临床研究专项(202140366);上海市金山区卫生健康委员会科研项目(JSKJ-KTQN-2021-04);复旦大学附属金山医院重点人才基金项目(JYRC-2020-1);复旦大学附属金山医院人才队伍建设三年行动计划(2023—2025年)重点发展学科群建设项目(ZDXK-2023-6)
DOI:10.3760/cma.j.cn101441-20221106-00484
子宫内膜异位症介绍
子宫内膜异位症(endometriosis,EMS)是一种子宫内膜样组织异位在子宫体以外的部位时引起的疾病。该病属于我国育龄期女性较常见的疾病之一,且发病率逐年上升。异位生长的子宫内膜可以侵犯并种植于腹膜、卵巢及直肠等全身多个脏器,致使出现痛经、非经期的盆腔痛、性交疼痛和月经改变等。EMS可通过排卵障碍、黄体形成不良及高泌乳素血症等影响生育功能,引起高达40%~50%的不孕率 [1]。此外,EMS可改变盆腔微环境,增加不良妊娠结局,如自然流产、异位妊娠、早产及前置胎盘等的发生[2]。EMS如今已逐渐成为困扰育龄期女性的一大难题,严重影响着众多女性的生活质量和生育要求。EMS虽为良性疾病,却表现出类似于肿瘤细胞快速增殖、高侵袭活性和较低凋亡率的生物学行为。目前EMS存在多种疾病假说,但是均无法完全说明该疾病的发生机制,迫切需要探索新的更全面的疾病机制。泛素是一组由76个氨基酸残基所组成的小分子量蛋白物质,它的生物学功能极为广泛,可通过介导蛋白质转运、降解、合成以及参与细胞内DNA修复、炎症反应应答等过程参与细胞的生命活动。泛素化过程必须具有以下三步酶级联反应,该过程相对复杂且可被高度调控,第一步为E1泛素激活酶与泛素交联形成硫酯键,第二步则是E2泛素结合酶与泛素蛋白之间相结合,第三步指泛素的羧基端和底物蛋白的赖氨酸残基在E3泛素连接酶的作用下形成异肽键。同时,泛素化这一过程往往也是可逆的,通常被称为去泛素化。去泛素化定义为被泛素化的蛋白质在去泛素化酶的作用下被水解为更小分子结构的多肽,进而释放入循环被应用[3] 。在泛素化和去泛素化的过程中,E3泛素连接酶和去泛素化酶均一直扮演着重要的角色,本文将综述不同的E3泛素连接酶和去泛素化酶在EMS中的表达情况、生物学行为以及发挥作用的信号通路。
一、E3泛素连接酶
E3泛素连接酶备受研究者关注的原因在于其能特异性识别底物的能力,它可以直接与底物蛋白结合,也可以通过衔接分子间接与底物蛋白结合。根据泛素的特征结构域及其与靶蛋白的相互作用特点可将其进行分类,其中最常见的是HECT结构域蛋白家族和RING结构域蛋白家族。具有HECT结构域的泛素可以直接结合并将底物蛋白泛素化,但是具有RING结构域的泛素蛋白却需要间接地将被活化的泛素从E2结合酶转移至底物蛋白进而发挥作用。结合目前国内外相关文献报道,有多种E3泛素连接酶参与了EMS的发生。
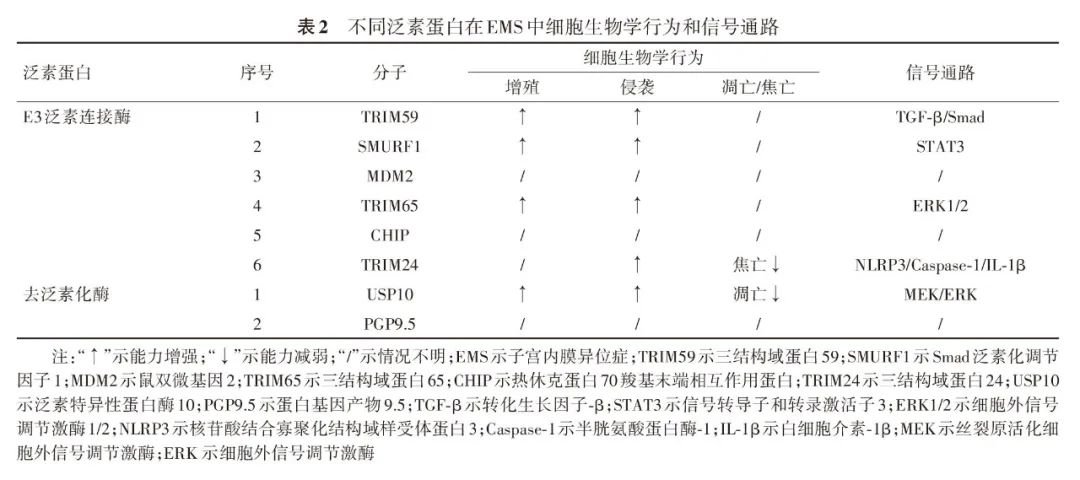
1、在EMS中表达增加的E3泛素连接酶:迄今为止,在EMS中检测到4种表达增加的E3泛素连接酶,分别为三结构域蛋白(tripartite motif-containing, TRIM)59、Smad泛素化调节因子1(smad ubiquitin regulatory factor 1,SMURF1)、鼠双微基因2(murine double minute 2, MDM2)和TRIM65,这些分子在EMS组织和细胞中的蛋白表达均增加,它们与特定的底物分子相结合,且两者蛋白表达呈负相关,并通过一定的信号通路促进异位内膜间质细胞的增殖和侵袭能力。其中MDM2在EMS中的信号通路及对细胞的生物学行为影响不明。详见表1和表2中E3泛素连接酶序号1~4。

(1)TRIM59:TRIM59是一种归属于TRIM蛋白质家族的表面分子,这个家族至今至少已经包含了77个成员,涉及到多种生理过程,如细胞增殖、免疫、抗病毒、肿瘤形成和多种细胞转录功能调节,参加控制了多种细胞生物过程,如细胞生长和细胞转移等。TRIM59在肿瘤增殖和迁移中发挥重要作用,Zhan等[4]观察到TRIM59可与靶蛋白相互作用后增强非小细胞肺癌的增殖和迁移能力。镁离子依赖的蛋白磷酸酶1A(protein phosphatase magnesium-dependent 1A ,PPM1A)隶属于丝/苏氨酸蛋白磷酸酶PP2C家族的成员,被认为是转化生长因子-β(transforming growth factor β,TGF-β)信号通路中一个关键的抑制调节因子。PPM1A参加了细胞周期进展、细胞周期性死亡、增殖和分化等多种生理过程。Lin等[5]和Dai等[6]表明,PPM1A与被激活的Smad家族成员2/3(Smad2/3)发生相互作用,并进一步通过Smad2/3的去磷酸化促进其核输出,从而终止TGF-β/Smad信号级联。Wang等[7]研究显示EMS组织中TRIM59的表达水平较对照组显著增加,而PPM1A的表达水平则显著低于对照组。对EMS患者的子宫内膜细胞进行研究,通过免疫共沉淀法显示TRIM59能够与PPM1A相结合,过表达TRIM59能明显增加PPM1A的泛素化水平。异位内膜间质细胞中TRIM59与PPM1A的表达呈负相关,TRIM59蛋白的过度表达显著促进了PPM1A的泛素化水平,抑制了PPM1A表达[7],该过程中TGF-β/Smad2/3信号通路被激活,异位内膜间质细胞的增殖和侵袭能力增强。实验证实TRIM59通过泛素化减弱了PPM1A,并激活TGF-β/Smad途径,促进了EMS异位内膜间质细胞的增殖和侵袭,TRIM59作为一种E3泛素连接酶在EMS的发生中发挥了重要作用。
(2)SMURF1:SMURF1是一种隶属于Nedd4家族内的E3泛素连接酶,通过靶向结合泛素化和蛋白酶降解的底物蛋白而发挥作用。SMURF1可以介导各种过程的发生,如肿瘤进展、轴突发生和胚胎发育等,并激活信号转导子和转录激活子3(signal transducers and activators of transcription 3,STAT3)信号通路[8]。微小RNA-154-5p(microRNA-154-5p,miR-154-5p)通过SMURF1泛素化调节TGF-β1/Smads通路,促进糖尿病肾病的纤维化进程[9]。分析表明SMURF1与酪氨酸磷酸酶-1(Src homology region 2 domain-containing phosphatase 1,SHP-1)可相互发生作用。通过研究,Zhang等[10]观察到SHP-1蛋白可以通过发生泛素化并被降解后进入泛素蛋白酶体途径。Bian等[11]通过对EMS进行研究,观察到SMURF1在EMS组织中表达量上调,SHP-1表达量下调,两者表达呈现负相关。进一步对子宫内膜间质细胞进行研究,结果显示作为E3泛素连接酶的SMURF1通过SHP-1的泛素化和降解激活STAT3信号通路及其下游靶点基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)和MMP9的表达量,增强了子宫内膜间质细胞的侵袭及增殖能力,然而这种能力的增强却可以被SHP-1抑制。研究证实作为E3泛素连接酶的SMURF1,其介导的SHP-1泛素化参与了EMS的发生。
(3)MDM2:MDM2属于E3泛素连接酶家族的众多成员之一,MDM2蛋白可以通过泛素化途径促进p53的蛋白降解[12]。MDM2与相对分子质量为30 000的VHL基因(p von Hippel-Lindau 30,pVHL30)这两种E3泛素连接酶之间存在协同作用,同时过表达MDM2和pVHL30可降低细胞代谢活性和坏死[13]。据报道,MDM2与雌激素受体α(estrogen receptor α,ERα)信号通路有关,MDM2泛素化在卵巢切除的APP/PS1小鼠中对钙通道蛋白1.2(calcium channel protein 1.2,Cav1.2)的ERα调节发挥了重要作用[14]。在EMS中,MDM2表达量增加,这种过表达与子宫内膜功能障碍、细胞周期改变以及EMS的疾病进展密切相关[15]。Chen等[16]研究表明,MDM2和ERα位于细胞核内且两者可相互结合,在MDM2的存在下ERα泛素化增强,MDM2的高表达促进了EMS ERα的泛素化降解,ERα表达降低,这表明MDM2作为一种E3泛素连接酶在EMS的发生中发挥了一定作用。
(4)TRIM65:TRIM65作为一种E3泛素连接酶可以通过激活细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)通路调节细胞增殖、凋亡、迁移、侵袭以及细胞周期[17]。Wu等[18]研究显示,EMS组织中TRIM65表达增加,进一步体外分离培养异位内膜间质细胞,显示TRIM65、人髓细胞增生原癌基因(cellular myelocytomatosis oncogene,C-myc)和p-ERK1/2表达量均上调,TRIM65表达与C-myc和p-ERK1/2表达呈正相关。敲降TRIM65后显示异位内膜间质细胞的增殖和侵袭能力均减弱、ERK1/2活性减弱,C-myc、MMP-2和整合素β1表达下调,这表明TRIM65能够通过ERK1/2信号通路调节异位内膜间质细胞的生物学行为。双特异性磷酸酶6(dual-specificity phosphatase 6,DUSP6)是ERK1/2信号通路负反馈的调节因子之一,同时也是TRIM65的主要结合蛋白,其在EMS组织中表达下调,与TRIM65表达呈负相关。在异位子宫内膜间质细胞中TRIM65诱导DUSP6泛素化,对TRIM65进行基因敲降后DUSP6的泛素化作用减弱,对DUSP6进行基因敲降后ERK1/2活性增强,异位内膜间质细胞侵袭能力增强[18]。研究证实TRIM65结合并泛素化DUSP6,通过ERK1/2/C-myc途径促进异位内膜间质细胞的增殖和侵袭,表明TRIM65作为一种E3泛素连接酶参与了EMS的发生。
2、在EMS中表达降低的E3泛素连接酶:结合国内外研究,目前在EMS中表达降低的E3泛素连接酶仅2种,为热休克蛋白70 羧基末端相互作用蛋白(carboxyl terminus of Hsc70-interacting protein,CHIP)和TRIM24,两者在EMS组织和/或细胞中蛋白表达下降,且和特定的底物分子相结合,与底物蛋白表达呈负相关。其中TRIM24可通过特定的信号通路增强异位细胞侵袭并减少焦亡,但CHIP在EMS中的信号通路及对细胞的生物学行为影响尚不明确。详见表1和表2中E3泛素连接酶序号5和6。
(1)CHIP:CHIP属于E3泛素连接酶成员之一。在非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的癌组织和NSCLC干细胞中均检测记录到了CHIP表达量下调,然而热休克蛋白90β(heat shock protein 90β,Hsp90β)和微管相关丝氨酸/苏氨酸激酶1(microtubule associated serine/threonine kinase 1,MAST1)表达量却上调,CHIP通过阻断Hsp90β与MAST1的相互作用促进MAST1泛素化,抑制MAST1蛋白的稳定性[19]。Cheng等[20]研究表明人乳腺癌MCF7细胞可通过CHIP介导的泛素-蛋白酶体途径使内源性雌激素受体β(estrogen receptor β,ERβ)泛素化水平降低。BCL相关抗死亡基因2(BCL2 associated athanogene 2,BAG2)是CHIP复合物的主要组成部分,BAG2可以调节CHIP介导的靶蛋白泛素化[21]。BAG2可以通过终止与CHIP/E2之间的协同作用而有效地抑制了CHIP泛素连接酶的活性[22]。Zhao等[23]揭示了二苯吲哚酮G通过与CHIP泛素连接酶发生相互作用,阻碍ERα的转录活性并恢复ERβ的转录活性从而有助于调节乳腺癌ER蛋白的稳定性。在EMS中,ERα和ERβ可通过泛素蛋白酶体途径被E3泛素连接酶降解。研究显示ERβ主要位于细胞核中,CHIP位于细胞质和细胞核中,且CHIP与ERβ可发生相互作用。Chen等[16]研究表明EMS组织中ERβ表达明显升高,CHIP表达与ERβ表达呈负相关。同时表明BAG2表达明显升高,在BAG2的存在下,ERβ的泛素化减少,而蛋白表达增强,表明BAG2可以抑制CHIP泛素连接酶的活性从而减轻EMS ERβ降解[16]。E3泛素连接酶之一CHIP在EMS中发挥了作用。
(2)TRIM24:TRIM24是E3泛素连接酶的家族成员之一,作为炎症反应的负转录调节因子,参与了妇科肿瘤的进展[24]。水泡性口炎病毒在感染后可以诱导大量TRIM24易位到细胞线粒体中,TRIM24和肿瘤坏死因子受体相关因子3(tumor necrosis factor receptor associated factors 3,TRAF3)相结合,同时可以直接诱导与K63连接的TRAF3泛素化。在TRAF3泛素化修饰过程中,TRAF3可与线粒体抗病毒信号蛋白和TANK结合激酶1选择性进行结合,并进一步有效地激活其下游抗病毒信号通路[25]。核苷酸结合寡聚化结构域样受体蛋白3[nucleotide-binding oligomerization domain (NOD)-like receptor containing pyrin domain 3,NLRP3]炎症体与EMS的疾病进展有关[26]。Hang等[27]研究显示,EMS患者的异位内膜组织中TRIM24 蛋白表达明显下降,体外培养异位内膜间质细胞并过表达TRIM24后显示细胞的迁移能力下降。通过免疫共沉淀显示TRIM24与NLRP3相互结合,过表达TRIM24可增加NLRP3的泛素化水平。研究表明TRIM24泛素化结合NLRP3并通过NLRP3/Caspase-1/白细胞介素-1β介导的细胞焦亡途径参与了EMS的疾病进展[27]。研究揭示了EMS的重要分子机制,表明TRIM24作为一种E3泛素连接酶参与了EMS的发生。
二、去泛素化酶
去泛素化酶是一类能够使底物蛋白质发生去泛素化作用,调节各类细胞生理和病理过程的物质。靶蛋白质通过去泛素化酶进行去泛素化作用之后,蛋白质的生物活性和稳定性均得到下降。目前,去泛素化酶分类中较常见的亚类是泛素特异性蛋白酶(ubiquitin specific proteases, USPs)和泛素C端水解酶。其中,USPs是最大的亚类,可以从被单泛素化或被多泛素化的底物中切割泛素前体,稳定下游蛋白进而防止其被降解,当USPs表达量发生改变可导致疾病的出现。
至今,在EMS中发现的去泛素化酶有两种,分别为泛素特异性蛋白酶10(ubiquitin-specific protease 10,USP10)和蛋白基因产物9.5(protein gene product 9.5,PGP9.5)。USP10属于泛素特异性蛋白酶,PGP9.5属于泛素C端水解酶。USP10可结合特定的底物分子,并通过一定的信号通路增强异位内膜间质细胞的增殖和侵袭能力,同时降低了细胞的凋亡,但是PGP9.5在EMS中的作用机制有待进一步研究发现。详见表1和表2中去泛素化酶序号1和2。
1、USP10:USP10作为去泛素化蛋白酶家族中的主要成员之一,可以调节细胞周期、细胞凋亡和血管生成等。USP10对编码p53蛋白的抑癌基因TP53的失稳对新生儿自噬和存活至关重要,USP10缺陷导致E3连接酶MDM2活性降低和细胞质TP53的积累,这干扰了自噬相关基因12(autophagy related gene 12,ATG12)和ATG5的结合,并最终抑制新生小鼠的自噬[28]。USP10是一种在癌症发展和进展中起主要作用的去泛素化酶,Xia等[29]在小鼠动脉中检测到USP10的表达,从小鼠颈动脉结扎模型中发现颈动脉结扎后USP10表达增加,且USP10的抑制表现出较薄的新生内膜。研究显示USP10基因缺陷减弱了大鼠胸主动脉平滑肌细胞(A7r5)和人主动脉平滑肌细胞的迁移能力与增殖能力。原代培养EMS患者的异位内膜间质细胞,结果显示USP10 mRNA表达上调,这种上调诱导丝裂原活化细胞外信号调节激酶/细胞外信号调节激酶(mitogen-activated extracellular signal regulated kinase/extracellular signal-regulated kinase, MEK/ERK)活性增强,并通过该信号通道促进了异位内膜间质细胞的迁移与增殖,同时抑制细胞凋亡。丝/苏氨酸蛋白激酶-1(serine/threonine kinase-1,Raf-1)是MEK/ERK信号通路的关键上游,与EMS中细胞的迁移有关[30]。USP10上调显著诱导了Raf-1蛋白的表达,而Raf-1 mRNA的表达却没有发生改变,USP10结合Raf-1并使其去泛素化来诱导Raf-1蛋白表达[31],USP10作为去泛素化酶通过激活Raf-1/MER/ERK信号通路参与了EMS的发生发展。
2、PGP9.5:PGP9.5作为泛素C端水解酶的成员之一,能够特异性解离泛素肽键,进而调节蛋白酶体和泛素信号通路介导的蛋白水解[32],并参与神经细胞分化、细胞凋亡和细胞周期调控等。Zevallos等[33]免疫组织化学结果证明EMS患者的子宫内膜中PGP9.5为阳性,而非EMS患者该蛋白则不表达,且疼痛性EMS患者的增殖期PGP9.5 mRNA表达明显增加。结果表明PGP9.5可能通过去泛素化结合靶蛋白参与了EMS的发生,但是PGP9.5在EMS中发挥作用的具体途径仍然不清楚。
三、总结与展望
EMS是女性常见病,发病率每年进行性升高,不仅降低了女性患者群体的生活质量,而且影响了她们的生育能力。EMS具有一些类似于肿瘤细胞高增殖、高侵袭和低凋亡的恶性生物学行为表现,然而其具体的发病机制仍不能明确。E3泛素连接酶有着很广泛的生物学功能,可通过增强细胞增殖和侵袭的能力,干预细胞通路,参与EMS的疾病进展。去泛素化酶通过特异性结合并降解靶蛋白而参与EMS的发生。然而相关文献报道有限,泛素蛋白在EMS局部微环境中的表达及作用机制需要被更多研究者探讨。尽管目前针对EMS中泛素蛋白的相关研究仍然处于早期阶段,我们需要对泛素蛋白参与EMS疾病进展的研究充满期待,并希望发现新的特异且更加有效的治疗靶点干预EMS的发生,造福饱受疾病困扰的广大EMS患者。